- Biopsie excisionnelle ou incisionnelle
– Une biopsie par FNA seule ne convient généralement pas pour le diagnostic initial d’un lymphome.
– Une biopsie au trocart n’est pas optimale, mais peut être utilisée dans certaines circonstances.
– Dans certaines circonstances, lorsqu’un ganglion lymphatique n’est pas facilement accessible pour une biopsie excisionnelle ou incisionnelle, une combinaison de biopsies au trocart (plusieurs biopsies de préférence) et de biopsies par FNA en association avec des techniques auxiliaires appropriées pour le diagnostic différentiel (immunohistochimie [IHC], cytométrie de flux, PCR pour réarrangements de gènes IGHV et TCR, caryotype et test FISH pour les translocations majeures*) pourrait convenir.
- L’évaluation histologique ne peut pas être effectuée sur une biopsie par FNA.
- Examen hématopathologique de toutes les lames avec au moins un bloc de paraffine représentatif de la tumeur. Effectuer une nouvelle biopsie si l’échantillon de consultation ne permet pas le diagnostic.
TESTS DIAGNOSTIQUES SUPPLÉMENTAIRES
-
Essentiel
- Immunophénotypage adéquat afin de poser le diagnostica
– Série de tests IHC : CD20, CD3, CD5, cycline D1, CD10, CD21, CD23, BCL2, BCL6, TP53, SOX11, Ki-67b avec ou sans
– Analyse des marqueurs de surface cellulaire par cytométrie de flux avec échantillon de sang périphérique et/ou de biopsie : kappa/lambda, CD19, CD20, CD5, CD23, CD10, CD200
- Séquençage TP53 c
- IHC : Le LEF1 peut aider à distinguer une variante de la LLC; le séquençage SOX11 ou IGHV peut être utile pour déterminer un LCM cliniquement indolentd; peut également contribuer au diagnostic d’un LCM CCND1-
- Caryotype ou FISH : t(11;14), t(14;18), panel LLC
- Analyse des marqueurs de surface cellulaire par cytométrie de flux avec échantillon de sang périphérique et/ou de biopsie : CD200
- Immunophénotypage adéquat afin de poser le diagnostica
BILAN INITIAL
-
Essentiel
- Examen physique : une attention doit être portée aux zones comportant des ganglions, y compris l’anneau de Waldeyer, et à la taille du foie et de la rate
- Indice fonctionnel
- Symptômes B
- Hémogramme, différentiel
- Bilan métabolique complet
- LDH
- TDM C/A/P avec produit de contraste de qualité diagnostique
- La TEP/TDM du corps entier est essentielle si une RT pour une maladie de stade I ou II ou un traitement systémique sont prévus
- Test de l’hépatite Be si un traitement par le rituximab est envisagé
- Échocardiogramme ou scanner MUGA si un schéma thérapeutique à base d’anthracycline ou d’anthracènedione est indiqué
- Test de grossesse chez les femmes en âge de procréer (si chimiothérapie ou RT envisagée)
- Endoscopie/colonoscopief
- Biopsie ± ponction de la moelle osseuse
- TDM du cou avec contraste
- Acide urique
- Bêta-2-microglobuline
- Test de l’hépatite C
- Ponction lombaire (pour la variante blastique ou les symptômes du SNC)
- Discussion des problèmes de fertilité et du stockage de sperme
FNA = fine needle aspiration (aspiration à l’aiguille fine); IHC = immunohistochimie; PCR = polymerase chain reaction (réaction en chaîne de la polymérase); IGHV = immunoglobulin heavy chain variable (région variable des chaînes lourdes des immunoglobulines); TCR = T-cell receptor (récepteur des lymphocytes T); FISH = fluorescent in situ hybridization (hybridation in situ fluorescente); LEF1 = lymphoid enhancer-binding factor 1; LLC = leucémie lymphoïde chronique; CCND1 = cycline D1; LDH = lactate déshydrogénase; C/A/P = chest/abdominal/pelvic (thoracique/abdominale/pelvienne); TDM = tomodensitométrie; TEP = tomographie à émission de positons; RT = radiothérapie; MUGA = multigated acquisition (ventriculographie isotopique à l’équilibre); SNC = système nerveux central.
* S’il subsiste une forte suspicion d’un processus clonal et que les autres techniques n’ont pas permis d’identifier clairement un processus clonal, un séquençage de nouvelle génération (NGS) peut être utilisé.
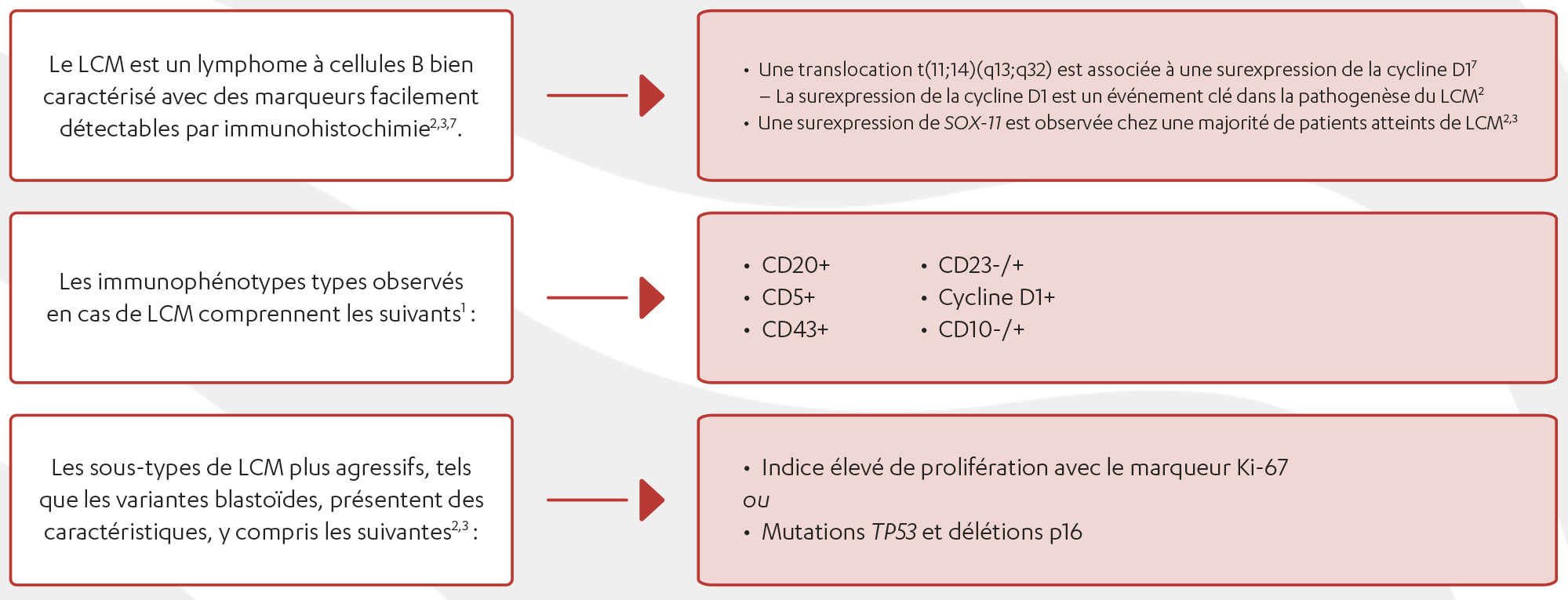
- Immunophénotype typique : CD5+, CD20+, CD43+, CD23-/+, cycline D1+, CD10-/+. Remarque : Certains cas de LCM peuvent être CD5- ou CD23+. Si le diagnostic est suspecté, il faut procéder à une coloration à la cycline D1 ou à un test FISH pour t(11;14). Il existe de rares cas de LCM CCND1- (< 5 %) avec un immunophénotype typique.
- La fraction de prolifération avec le marqueur Ki-67 < 30 % dans les ganglions lymphatiques est associée à un pronostic plus favorable.
- La mutation TP53 a été associée à un mauvais pronostic chez les patients ayant reçu un traitement conventionnel, notamment une greffe. Un essai clinique est fortement suggéré pour ces patients. Le test du gène TP53 par IHC n’est pas un substitut éprouvé pour confirmer la mutation du gène TP53 ou une délétion 17p.
- Le biomarqueur le plus courant pour une maladie indolente : SOX11- [IGHV-muté]. Tableau clinique type : leucémique non ganglionnaire de type LLC avec splénomégalie, faible charge tumorale, fraction de prolifération avec le marqueur Ki-67 < 10 %.
- Des tests pour l’hépatite B sont indiqués en raison du risque de réactivation par le traitement immunothérapie + chimiothérapie. Les tests comprennent l’antigène de surface de l’hépatite B et l’anticorps dirigé contre l’antigène nucléocapsidique du virus de l’hépatite B pour un patient sans facteurs de risque. Pour les patients présentant des facteurs de risque ou des antécédents d’hépatite B, ajouter l’antigène Hbe. Si le test est positif, vérifier la charge virale et envisager de consulter un gastro-entérologue.
- Essentiel pour la confirmation d’une maladie de stade I-II.
Texte adapté avec la permission de NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for B-Cell Lymphomas V.1.2022 – 2 mars 2022. © 2022. National Comprehensive Cancer Network, Inc. Tous droits réservés. Les NCCN Guidelines® (recommandations du NCCN) et les illustrations ci-incluses ne peuvent être reproduites sous aucune forme ni à aucune fin sans la permission écrite expresse du NCCN. Pour consulter la plus récente version complète des recommandations du NCCN, visitez le site NCCN.org. Les recommandations du NCCN ne sont pas figées et peuvent être modifiées chaque fois que de nouvelles données significatives deviennent disponibles. Le NCCN n’offre aucune garantie quant à leur contenu, leur utilisation ou leur application, et décline toute responsabilité relative à leur application ou leur utilisation de quelque façon que ce soit.
TYPES DE LCM
LCM classique (70 à 80 %)2
Lymphadénopathie symptomatique ou maladie extra-ganglionnaire symptomatique nécessitant un traitement systémique.
LCM extra-ganglionnaire/ganglionnaire latent et LCM purement leucémique, non blastoïde et asymptomatique (10 à 20 %)2
Une stratégie « d’observation vigilante » doit être envisagée pour les patients asymptomatiques ayant un score MIPI faible ou les patients âgés en raison du pronostic défavorable et de l’efficacité limitée observés avec le traitement standard (c.-à-d. le traitement ne semble pas curatif) chez les patients atteints de LCM2,3.

LE PROCESSUS DIAGNOSTIQUE LIÉ AU LCM
Un diagnostic de LCM exige une confirmation histopathologique d’infiltration des ganglions lymphatiques. Une partie (ou la totalité) d’un ganglion lymphatique hypertrophié et facilement accessible sera retirée4–6.
Le rapport histologique doit établir le diagnostic selon la classification de l’Organisation mondiale de la Santé (OMS) et le marqueur de prolifération Ki-67 (facteur de risque histomorphologique le mieux établi)6.
La plupart des tumeurs ont une structure classique et sont constituées de cellules de taille petite à moyenne, avec des noyaux irréguliers. Toutefois, les lymphocytes malins peuvent se présenter sous différentes formes6.
L’immunophénotypage avec cytométrie de flux joue désormais un rôle intégrant dans la sous-classification des lymphomes à cellules B (figure 2)7.
Les sous-types de LCM présentent différents tableaux cliniques2.

| Sous-type de LCM | Caractéristiques cliniques |
|---|---|
| LCM classique |
|
| LCM extra-ganglionnaire/ganglionnaire latent |
|
| LCM purement leucémique, non blastoïde et asymptomatique |
|
D’après Jain P et Wang M, 2019.
LDH = lactate déshydrogénase; MIPI = mantle cell lymphoma international prognostic index (indice pronostique international du lymphome à cellules du manteau); TEP = tomographie à émission de positons; SUV = standardized uptake value (valeur de fixation normalisée); FISH = fluorescent in situ hybridization (hybridation in situ fluorescente).
RÉFÉRENCES :
- Cité en référence avec l’autorisation de NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for B-Cell Lymphomas V.1.2022 – 2 mars 2022. © National Comprehensive Cancer Network, Inc. 2022. Tous droits réservés. Consulté le 4 mars 2022. Pour consulter la plus récente version complète des recommandations du NCCN, visitez le site NCCN.org. Le NCCN n’offre aucune garantie quant à leur contenu, leur utilisation ou leur application, et décline toute responsabilité relative à leur application ou leur utilisation de quelque façon que ce soit.
- Jain P, Wang M. Mantle cell lymphoma: 2019 update on the diagnosis, pathogenesis, prognostication, and management. Am J Hematol 2019;94:710–25.
- Vose J. Mantle cell lymphoma: 2017 update on diagnosis, risk-stratification, and clinical management. Am J Hematol 2017;92:806–13.
- Société de leucémie et lymphome. Lymphome à cellules du manteau. En ligne à l’adresse : https://www.lls.org/sites/default/files/National/USA/Pdf/Publications/FS4F_FR_MCL_Facts_2018.pdf. Consulté le 24 août 2021.
- National Organization for Rare Disorders (NORD). Mantle cell lymphoma: General discussion. Consulté le 28 novembre 2020 à l’adresse : https://rarediseases.org/rare-diseases/mantle-cell-lymphoma/.
- Dreyling M, et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2017;28(S4):iv62-iv71. Annals of Oncology 2017;28(S4):iv62–iv71.
- Aqil B, et al. Immunophenotypic Variations in Mantle Cell Lymphoma and Their Impact on Clinical Behavior and Outcome. Arch Pathol Lab Med 2018;142(10):1268–74.
- McKay P, et al. A British Society for haematology good practice paper on the diagnosis and investigation of patients with mantle cell lymphoma. British Journal of Haematology 2018;182:63-70.